Soal PAT Kimia Kelas 10 SMK Tahun 2022 dan Kunci Jawaban

Centralpendidikan.com - Halo siswa SMK, melalui artikel ini kami akan membagikan Berkas Pendidikan berupa Contoh Soal PAT Kimia Kelas 10 SMK jurusan TKJ dan TBSM tahun pelajaran 2022/2023 sesuai kisi - kisi mata pelajaran bengkel yang dipelajari siswa.
Berkas ini diperlukan bapak/ibu guru pengajar sebagai referensi dalam penyusunan lembar ujian Penilaian Akhir Tahun di mapel Kimia Kelas 10. Sedangkan bagi siswa cocok digunakan sebagai bahan belajar agar mendapatkan nilai terbaik di kegiatan evaluasi tahunan tersebut.
Selanjutnya, untuk perincian dokumennya adalah 2 Paket Soal PAT Kimia Kelas 10, gambaran dokumen, serta kunci jawaban yang kami letakkan di lampiran.
Soal PAT Kimia Kelas 10 SMK Tahun 2022 dan Kunci Jawaban
Selengkapnya, bagi bapak/ibu guru dan siswa kelas XI yang ingin mendownload Soal PAT Kimia Kelas 10 Kurikulum 2013 dan Kunci Jawaban silahkan menyimak artikel di bawah ini.
File PDF + Jawaban di akhir artikel.
Selamat mengerjakan..
1. Senyawa berikut yang bukan merupakan anggota alkena adalah ....
a. Etena
b. Pentena
c. Metana
d. Butena
e. Propena
2. Senyawa yang mempunyai dua buah ikatan rangkap adalah ....
a. C2H4
b. C3H8
c. C3H6
d. C3H4
e. CH4
3. Di antara bahan di bawah ini, yang merupakan hasil industri dari senyawa alkena adalah ....
a. Tekstil
b. Kertas
c. Plastik
d. Lilin
e. Pupuk
4. Gas asetilena termasuk deret ....
a. Alkana
b. Alkena
c. Alkadiena
d. Alkuna
e. Hidrokarbon
5. Dalam setiap molekul alkuna ....
a. Terdapat setidaknya satu ikatan rangkap tiga
b. Terdapat setidaknya satu ikatan rangkap
c. Jumlah atom H lebih sedikit dari pada atom C
d. Semua atom karbon mengikat 4 atom H
e. Semua ikatan antar atom karbon merupakan ikatan rangkap tiga
6. Berikut adalah sifat-sifat khas atom karbon, kecuali ....
a. Merupakan unsur logam
b. Atom karbon dapat membentuk empat ikatan kovalen
c. Mempunyai empat elektron valensi
d. Atom karbon dapat membentuk rantai karbon
e. Dapat membentuk ikatan kovalen tunggal, rangkap dua, dan rangkap tiga
7. Zat yang di tambahkan untuk meningkatkan bilangan oktan pada bensin adalah ....
a. n-butana
b. Tetraetyl lead (TEL)
c. Nafta
d. Isooktana
e. n-heptana
8.
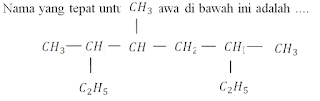
a. 6-etil-3,4-dimetil heptana
b. 2,5-dietil-3-metil hepsana
c. 3,4,6-trimetil oktana
d. 3,5,6-trimetil oktana
e. 2-etil-4,5-dimetil heptana
9.
b. 2,5-dietil-3-metil hepsana
c. 3,4,6-trimetil oktana
d. 3,5,6-trimetil oktana
e. 2-etil-4,5-dimetil heptana
9.

a. 2,4,5 trimetil heptana
b. 2 –etil,4,5-metil heksana
c. 2,3,5 trimetil heptana
d. 2,2,3 trimetil heptana
e. 2 –etil-3,4-metil heksana
10. Jumlah isomer alkuna dengan rumus C5H8 adalah ....
a. 4
b. 3
c. 6
d. 5
e. 7
11. Senyawa berikut yang bukan merupakan minyak bumi adalah ....
a. Aspal
b. Kerosin
c. Nafta
d. Keton
e. Bensin
12. Cara yang digunakan untuk memisahkan fraksi-fraksi minyak bumi adalah ....
a. Adisi
b. Dekantasi
c. Sublimasi
d. Ekstraksi
e. Distilasi
13. Konversi minyak bumi menjadi bensin dilakukan dengan cara ....
a. Adisi
b. Blending
c. Cracking
d. Reforming
e. Substitusi
14. Berikut ini yang bukan hasil dari industri petrokimia adalah ....
a. Karet
b. Pupuk
c. Asbes
d. Plastik
e. Detergen
15. Hasil pembakaran tidak sempurna dari minyak bumi adalah ....
a. NO
b. CO2
c. NH3
d. CO
e. NO2
16. Larutan elektrolit adalah ....
a. Larutan yang dapat terjadi
b. Larutan yang mengalir
c. Larutan yang dapat menghantarkan listrik
d. Larutan yang tidak dapat menghantarkan listrik
e. Larutan yang hanya menghasilkan senyawa
17. Yang termasuk elektrolit kuat adalah ....
a. HF
b. CH3COOH
c. HNO2
d. NaCl
e. NH3
18. Larutan yang derajat ionisasinya besar adalah ....
a. Larutan elektrolit
b. Elektrolit lemah
c. Elektrolit kuat
d. Larutan non elektrolit
e. Larutan ionisasi
19. Larutan non elektrolit adalah ....
a. Larutan yang memerahkan lakmus biru
b. Garam yang terionisasi menjadi kation dan anion
c. Zat yang dalam larutannya dapat menghantarkan arus listrik
d. Larutan yang membirukan lakmus merah
e. Larutan yang tidak dapat menghantarkan arus listrik
20. Larutan berikut adalah elektrolit, kecuali ....
a. C6H12O6
b. Na2CO3
c. NH4OH
d. Ca(OH)2
e. CH3COOH
21. Suatu larutan merupakan penghantar listrik yang baik, jika larutan tersebut mengandung ....
a. Elektron yang bebas bergerak
b. Molekul-molekul zat terlarut
c. Ion-ion yang dapat bergerak bebas
d. Logam yang bersifat konduktor
e. Pelarut yang bersifat polar
22. Yang termasuk elektrolit lemah adalah ....
a. HCl
b. HNO2
c. NaCl
d. H2SO4
e. KOH
23. Larutan yang mengandung sedikit zat terlarut disebut ....
a. Pelarut
b. Air
c. Terlarut
d. Pekat
e. Encer
24. Kemolaran yang dibuat dengan melarutkan 6 gram CO( NH2)2 dalam 100 ml larutan (Mr CO(NH2)2 = 60) adalah ....
a. 2 mol L-1
b. 1 mol L-1
c. 0,1 mol L-1
d. 5 mol L-1
e. 4 mol L-1
25. Sebanyak 20 gram urea (Mr = 60) dilarutkan dalam 80 gram air (Mr = 18). Fraksi mol urea adalah ....
a. 0,096
b. 0,089
c. 0,079
d. 0,059
e. 0,069
26. Molalitas larutan 0,25 mol NaOH dalam 100 gram air adalah ....(Mr NaOH = 40)
a. 1,5 molal
b. 0,25 molal
c. 0,5 molal
d. 0,025 molal
e. 2,5 molal
27. Larutan yang mengandung banyak zat terlarut adalah ....
a. Encer
b. Pekat
c. Kemolalan
d. Kemolaran
e. Mol
28. Jumlah mol zat terlarut di dalam satu liter larutan disebut ....
a. Persen massa
b. Jumlah mol
c. Molaritas
d. Kemolalan
e. Fraksi mol
29. Berapakah kemolaran larutan yang dibuat dengan melarutkan 2 gram NaOH (Mr = 74) dalam 100 ml larutan adalah ....
a. 0,3 mol L-1
b. 0,8 mol L-1
c. 0,5 mol L-1
d. 0,7 mol L-1
e. 0,9 mol L-1
30. Jumlah mol zat terlarut dalam 1 kg pelarut (pelarut, bukan larutan) adalah ....
a. Pelarut
b. Molalitas
c. Kemolaran
d. Jumlah mol
e. Fraksi mol
31. Berapakah kemolalan larutan glukosa yang mengandung 12% massa glukosa (Mr = 180) adalah ....
a. 0,79 mol kg-1
b. 0,76 mol kg-1
c. 0,78 mol kg-1
d. 0,77 mol kg-1
e. 0,75 mol kg-1
32. Berapakah fraksi mol urea dalam larutan urea 20% (Mr = 60) adalah ....
a. 0,068
b. 0,074
c. 0,075
d. 0,065
e. 0,069
33. Berapa % massa larutan sebanyak 50 gram NaCl dilarutkan dalam 150 ml air adalah ....
a. 30 %
b. 40 %
c. 70 %
d. 60 %
e. 50 %
34. Berapa persen volume alkohol dalam larutan yang diperoleh sebanyak 30 ml alkohol dilarutkan dalam 150 ml air adalah ....
a. 16,6 %
b. 15,67%
c. 16,67 %
d. 16,57 %
e. 15,68%
35. Zat yang di larutkan dalam air yang menghasilkan ion H+ adalah ....
a. Netralisasi
b. Basa
c. Garam
d. Asam
e. Asam basa
36. Yang bukan termasuk ciri-ciri asam adalah ....
a. Bersifat korosif
b. Bereaksi dengan beberapa ion logam
c. PH kurang dari 7
d. Rasa asam
e. Rasa pahit
37. Pemberi pasangan elektron disebut ....
a. Asam
b. Netralisasi
c. Garam
d. Basa
e. Asam basa
38. Zat yang sedikit terionisasi disebut ....
a. Basa lemah
b. Penggaraman
c. Asam lemah
d. Asam kuat
e. Basa kuat
39. Reaksi asam dan basa yang menghasilkan garam dan air disebut ....
a. Reaksi reduksi oksidasi
b. Reaksi oksidasi reduksi
c. Reaksi reduksi
d. Reaksi penggaraman
e. Reaksi oksidasi
40. Berlangsungnya reaksi reduksi oksidasi yang bergantung pada kedudukan logam disebut ....
a. Reaksi penggaraman
b. Konsentrasi asam
c. Asam basa
d. Reduksi oksidasi
e. Deret volta
b. 2 –etil,4,5-metil heksana
c. 2,3,5 trimetil heptana
d. 2,2,3 trimetil heptana
e. 2 –etil-3,4-metil heksana
10. Jumlah isomer alkuna dengan rumus C5H8 adalah ....
a. 4
b. 3
c. 6
d. 5
e. 7
11. Senyawa berikut yang bukan merupakan minyak bumi adalah ....
a. Aspal
b. Kerosin
c. Nafta
d. Keton
e. Bensin
12. Cara yang digunakan untuk memisahkan fraksi-fraksi minyak bumi adalah ....
a. Adisi
b. Dekantasi
c. Sublimasi
d. Ekstraksi
e. Distilasi
13. Konversi minyak bumi menjadi bensin dilakukan dengan cara ....
a. Adisi
b. Blending
c. Cracking
d. Reforming
e. Substitusi
14. Berikut ini yang bukan hasil dari industri petrokimia adalah ....
a. Karet
b. Pupuk
c. Asbes
d. Plastik
e. Detergen
15. Hasil pembakaran tidak sempurna dari minyak bumi adalah ....
a. NO
b. CO2
c. NH3
d. CO
e. NO2
16. Larutan elektrolit adalah ....
a. Larutan yang dapat terjadi
b. Larutan yang mengalir
c. Larutan yang dapat menghantarkan listrik
d. Larutan yang tidak dapat menghantarkan listrik
e. Larutan yang hanya menghasilkan senyawa
17. Yang termasuk elektrolit kuat adalah ....
a. HF
b. CH3COOH
c. HNO2
d. NaCl
e. NH3
18. Larutan yang derajat ionisasinya besar adalah ....
a. Larutan elektrolit
b. Elektrolit lemah
c. Elektrolit kuat
d. Larutan non elektrolit
e. Larutan ionisasi
19. Larutan non elektrolit adalah ....
a. Larutan yang memerahkan lakmus biru
b. Garam yang terionisasi menjadi kation dan anion
c. Zat yang dalam larutannya dapat menghantarkan arus listrik
d. Larutan yang membirukan lakmus merah
e. Larutan yang tidak dapat menghantarkan arus listrik
20. Larutan berikut adalah elektrolit, kecuali ....
a. C6H12O6
b. Na2CO3
c. NH4OH
d. Ca(OH)2
e. CH3COOH
21. Suatu larutan merupakan penghantar listrik yang baik, jika larutan tersebut mengandung ....
a. Elektron yang bebas bergerak
b. Molekul-molekul zat terlarut
c. Ion-ion yang dapat bergerak bebas
d. Logam yang bersifat konduktor
e. Pelarut yang bersifat polar
22. Yang termasuk elektrolit lemah adalah ....
a. HCl
b. HNO2
c. NaCl
d. H2SO4
e. KOH
23. Larutan yang mengandung sedikit zat terlarut disebut ....
a. Pelarut
b. Air
c. Terlarut
d. Pekat
e. Encer
24. Kemolaran yang dibuat dengan melarutkan 6 gram CO( NH2)2 dalam 100 ml larutan (Mr CO(NH2)2 = 60) adalah ....
a. 2 mol L-1
b. 1 mol L-1
c. 0,1 mol L-1
d. 5 mol L-1
e. 4 mol L-1
25. Sebanyak 20 gram urea (Mr = 60) dilarutkan dalam 80 gram air (Mr = 18). Fraksi mol urea adalah ....
a. 0,096
b. 0,089
c. 0,079
d. 0,059
e. 0,069
26. Molalitas larutan 0,25 mol NaOH dalam 100 gram air adalah ....(Mr NaOH = 40)
a. 1,5 molal
b. 0,25 molal
c. 0,5 molal
d. 0,025 molal
e. 2,5 molal
27. Larutan yang mengandung banyak zat terlarut adalah ....
a. Encer
b. Pekat
c. Kemolalan
d. Kemolaran
e. Mol
28. Jumlah mol zat terlarut di dalam satu liter larutan disebut ....
a. Persen massa
b. Jumlah mol
c. Molaritas
d. Kemolalan
e. Fraksi mol
29. Berapakah kemolaran larutan yang dibuat dengan melarutkan 2 gram NaOH (Mr = 74) dalam 100 ml larutan adalah ....
a. 0,3 mol L-1
b. 0,8 mol L-1
c. 0,5 mol L-1
d. 0,7 mol L-1
e. 0,9 mol L-1
30. Jumlah mol zat terlarut dalam 1 kg pelarut (pelarut, bukan larutan) adalah ....
a. Pelarut
b. Molalitas
c. Kemolaran
d. Jumlah mol
e. Fraksi mol
31. Berapakah kemolalan larutan glukosa yang mengandung 12% massa glukosa (Mr = 180) adalah ....
a. 0,79 mol kg-1
b. 0,76 mol kg-1
c. 0,78 mol kg-1
d. 0,77 mol kg-1
e. 0,75 mol kg-1
32. Berapakah fraksi mol urea dalam larutan urea 20% (Mr = 60) adalah ....
a. 0,068
b. 0,074
c. 0,075
d. 0,065
e. 0,069
33. Berapa % massa larutan sebanyak 50 gram NaCl dilarutkan dalam 150 ml air adalah ....
a. 30 %
b. 40 %
c. 70 %
d. 60 %
e. 50 %
34. Berapa persen volume alkohol dalam larutan yang diperoleh sebanyak 30 ml alkohol dilarutkan dalam 150 ml air adalah ....
a. 16,6 %
b. 15,67%
c. 16,67 %
d. 16,57 %
e. 15,68%
35. Zat yang di larutkan dalam air yang menghasilkan ion H+ adalah ....
a. Netralisasi
b. Basa
c. Garam
d. Asam
e. Asam basa
36. Yang bukan termasuk ciri-ciri asam adalah ....
a. Bersifat korosif
b. Bereaksi dengan beberapa ion logam
c. PH kurang dari 7
d. Rasa asam
e. Rasa pahit
37. Pemberi pasangan elektron disebut ....
a. Asam
b. Netralisasi
c. Garam
d. Basa
e. Asam basa
38. Zat yang sedikit terionisasi disebut ....
a. Basa lemah
b. Penggaraman
c. Asam lemah
d. Asam kuat
e. Basa kuat
39. Reaksi asam dan basa yang menghasilkan garam dan air disebut ....
a. Reaksi reduksi oksidasi
b. Reaksi oksidasi reduksi
c. Reaksi reduksi
d. Reaksi penggaraman
e. Reaksi oksidasi
40. Berlangsungnya reaksi reduksi oksidasi yang bergantung pada kedudukan logam disebut ....
a. Reaksi penggaraman
b. Konsentrasi asam
c. Asam basa
d. Reduksi oksidasi
e. Deret volta
Diharapkan Soal PAT Kimia Kelas 10 SMK Tahun 2022 dan Kunci Jawaban bermanfaat untuk tenaga didik dan siswa sekalian.
